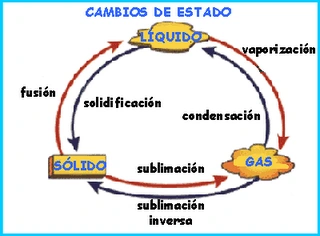
Fusión:
Es el cambio que presentan los sólidos al convertirse en líquidos cuando se someten a un aumento de temperatura; por ejemplo, la fundición de los metales en los altos hornos o el hielo que se funde en los polos al llegar la primavera.
Solidificación:
Es el cambio del estado liquido al solido; por ejemplo, cuando se congela el agua o cuando se deja enfriar la manteca de puerco.
Sublimación :Es el cambio del estado solido al gaseoso y viceversa, sin pasar por el estado liquido; ejemplos de este tipo son la sublimación del yodo y la naftalina.
Evaporación:
Es el cambio que se presenta cuando se pasa del estado liquido al gaseoso; por ejemplo, el agua cuando hierve y se convierte en vapor o la evaporación de la acetona cuando se deja destapado el frasco que la contiene.
Condensación y licuefaccion:
Son los cambios del estado gaseoso o vapor al liquido. Si se trata de vapor que cambia a liquido recibe el nombre de condensación, por ejemplo: las nubes al precipitarse en forma de lluvia. Si es un gas que se transforma en liquido se le denomina licuefaccion, como cuando el oxigeno, que es un gas, se convierte en liquido para fines medicinales.






